Em março de 2023, 11 exoesqueletos médicos foram aprovados pela FDA dos EUA para marcha, assistência à marcha e reabilitação física. A FDA classifica os exoesqueletos eléctricos médicos como dispositivos de classe II, código PHL, com a seguinte definição exacta "Um exoesqueleto motorizado é um dispositivo de prescrição que consiste numa ortótese externa motorizada colocada sobre a(s) extremidade(s) do abdómen de uma pessoa paralisada ou debilitada para fins médicos."
Os 11 exoesqueletos médicos não estão numa ordem específica:
- Keeogo Dermoskeleton System da B-Temia, exoesqueleto de joelho motorizado
- HAL para uso médico (tipo membro inferior) da CYBERDYNE, exoesqueleto motorizado para a anca e o joelho
- EksoNR Exosqueleto de anca-joelho motorizado da Ekso Bionics
- ExoAtlet-II da ExoAtlet Asia, também um exoesqueleto motorizado para a anca e o joelho
- Honda Walking Assist Device, Honda Motor Company, Exosqueleto de anca motorizado
- Indego, oficialmente da Parker-Hannifin Corporation, recentemente adquirida pela EksoBionics, exoesqueleto motorizado para a anca e o joelho.
- ReWalk da ReWalk Robotics, exosqueleto de anca-joelho motorizado
- ReWalk ReStore da ReWalk Robotics, exosuit com tornozelo motorizado
- GEMS-H da Samsung Electronics, exoesqueleto de anca motorizado
- Fénix da Ottobock, oficialmente suitX (que, por sua vez, era oficialmente US Bionics), é um exoesqueleto de anca motorizado com apoio passivo do joelho
- Atalante Exosqueleto de anca-joelho-tornozelo Wandercraft SAS
A partir de março de 2023, apenas o exoesqueleto ReWalk está aprovado pela FDA para utilização em escadas e passeios. Apenas o ReWalk Personal e o Indego estão aprovados para uso privado ou doméstico. Todos os dispositivos podem ser utilizados num centro de reabilitação. O Atalante é o único exoesqueleto auto-equilibrante aprovado pela FDA (embora o REX possa em breve ser adicionado à lista). Os restantes dispositivos têm auxiliares de mobilidade adicionais opcionais ou obrigatórios, como muletas ou um andarilho. Há vários dispositivos, como o Atalante, que podem ser utilizados por adolescentes (mas não há exoesqueletos pediátricos nesta lista). Todos os operadores devem completar um programa de formação antes de utilizarem os exoesqueletos.
Alguns dos exoesqueletos eléctricos aprovados pela FDA têm considerações especiais de proteção e mitigação de quedas, especificamente:
- Atalante: deve ser utilizado em combinação com um gradeamento de segurança.
- O ReWalk deve ser utilizado com muletas. O Indego, o ExoAtlet-II (e provavelmente o Phoenix) devem ser utilizados com muletas ou um rolo, enquanto o EksoNR pode ser utilizado com muletas, um rolo ou uma bengala.
- O HAL para fins médicos deve ser ligado a um sistema de suporte de peso corporal (normalmente suspenso).
- Todas as versões do ReWalk e do Indego, com exceção das versões para uso doméstico, foram aprovadas para utilização apenas sob a supervisão de um profissional médico qualificado.
O objetivo dos exoesqueletos eléctricos aprovados pela FDA é ajudar os doentes/utilizadores a andar:
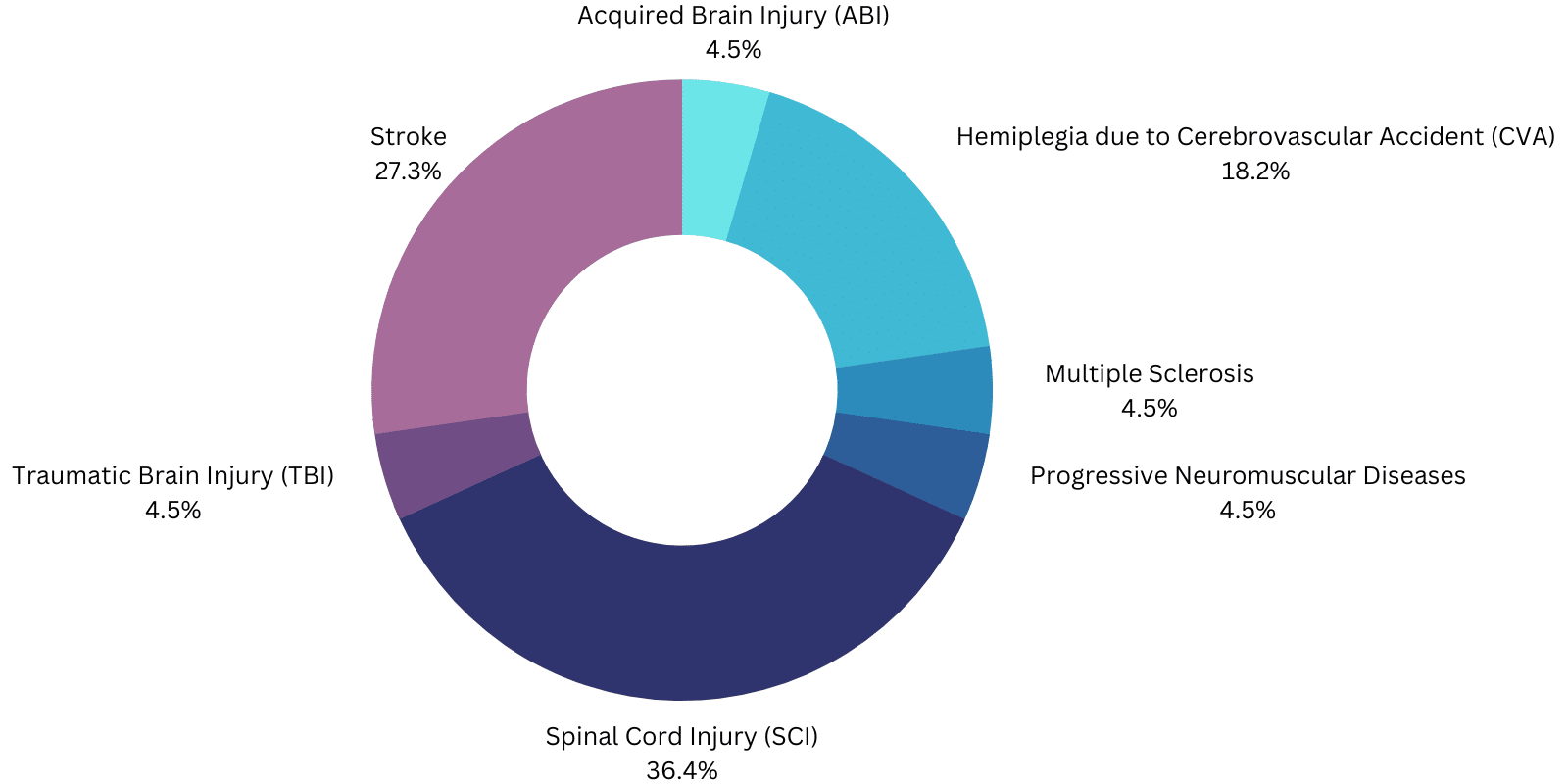
- O ExoAtlet-II destina-se à reabilitação funcional de indivíduos, sob a supervisão de um fisioterapeuta treinado, com função motora do membro superior de, pelo menos, 4/5 em ambos os braços, lesão da espinal medula (SCI) T4 a L5 ou C7 a T3 (ASIA D ).
- Fénix: Lesão da espinal medula (LM) ao nível de T4-L5.
- Atalante: Hemiplegia por acidente vascular cerebral (AVC).
- GEMS-H: Pessoas com AVC que apresentam défices de marcha e velocidades de marcha de, pelo menos, 0,4 m/s e que são capazes de caminhar, pelo menos, 10 metros com a ajuda de, no máximo, uma pessoa.
- ReWalk: SCI T7 a L5 para uso pessoal sob supervisão constante ou SCI T4 a T6 para reabilitação física numa instalação especial.
- ReWalk Restore: deve ser "utilizado para apoiar as funções ambulatórias em instalações de reabilitação sob a supervisão de um terapeuta treinado para pessoas com hemiplegia/hemiparesia devido a acidente vascular cerebral que podem andar pelo menos 1,5 m (5 pés) sem mais do que um apoio mínimo a moderado".
- Indego: assistência ambulatória para as LME de nível T3 a L5 para uso pessoal com acompanhamento e LME de nível C7 a L5 em centros de reabilitação ou hemiplegia por AVC com função motora 4/5 em pelo menos um membro superior.
- Honda Walking Assist: "Pessoas com AVC que têm défices de marcha e velocidades de marcha de pelo menos 0,4 m/s e que são capazes de andar pelo menos 10 metros com a ajuda de não mais do que uma pessoa" em instalações de reabilitação.
- EksoNR: "O EksoNRm destina-se a desempenhar funções de ambulatório em instalações de reabilitação, sob a supervisão de um fisioterapeuta qualificado, para as seguintes populações:
- Pessoas com esclerose múltipla (função motora do membro superior de pelo menos 4/5 em pelo menos um braço).
- Indivíduos com lesão cerebral adquirida, incluindo lesão cerebral traumática e acidente vascular cerebral (função motora do membro superior de pelo menos 4/5 em pelo menos um braço).
- Pessoas com lesões da espinal medula dos níveis T4 a L5 (função motora do membro superior de pelo menos 4/5 em ambos os braços).
- Indivíduos com lesões da espinal medula aos níveis C7 a T3 (ASIA D com função motora do membro superior de pelo menos 4/5 em ambos os braços).
Restrições de altura e peso comunicadas pelos utilizadores:
| Dispositivo: | Amplitude de altura do utilizador | Faixa de peso do utilizador |
| GEMS-H | 1,55m a 1,91m | 45 a 100 kg |
| Atalanta | 1,60 a 1,90 cm | até 90 kg |
| Fénix | 1,60m a 1,87m | até 91 kg |
| ReWalk | 1,60m a 1,90m | até 100 kg |
| Recuperação ReWalk | 1,42m a 1,92m | até 120 kg |
| Preciso de | 1,50m a 1,90m | até 113 kg |
| Andarilho Honda | 1,4 m a 2,0 m | até 100 kg |
| ExoAtleta-II | 1,60m a 1,90m | até 100 kg |
| ExoNR | 1,58m a 1,88m | até 100 kg |
| HAL para fins médicos | 1,50m a 1,90m | 40 a 100 quilos |
| O sistema de dermoesqueleto do Keego | 1,52m a 1,88m | até 130 kg |
Se encontrar algum erro ou desejar um artigo sobre um tema específico, não hesite em contactar-nos através do formulário de contacto ExR . Imagem em destaque (em cima): Demonstração do Ekso GT por Shane Mosko e a fisioterapeuta Jenn Macievich na sede da Ekso Bionics, Richmond, 2016 (fundo removido).
Fonte:
- Classificação do produto, FDA, acedido em março de 2023, Ligação
- Palermo AE, Maher JL, Baunsgaard CB, Nash MS. Revisão orientada para o clínico sobre a utilização de um exoesqueleto biónico após lesão da medula espinal. Top Spinal Cord Inj Rehabil. verão de 2017;23(3):234-244. doi: 10.1310/sci2303-234. PMID: 29339899; PMC ID: PMC5562031.
- Avaliação da segurança e desempenho do sistema Atalante em pacientes com membros inferiores
- Paralisia, NIH, 2018, Ligação
Fonte: Utilização proposta dos 11 exoesqueletos médicos aprovados pela FDA no Medical Exoskeleton Report 2023.
