Jusqu'en mars 2023, 11 exosquelettes médicaux ont été approuvés par la FDA américaine pour la marche, l'assistance à la marche et la rééducation physique. La FDA classe les exosquelettes à propulsion médicale comme des dispositifs de classe II, code PHL, avec la définition exacte suivante : "Un exosquelette motorisé est un dispositif sur ordonnance qui consiste en une orthèse motorisée externe placée sur le(s) membre(s) paralysé(s) ou affaibli(s) d'une personne à des fins médicales".
Les 11 exosquelettes médicaux ne sont pas dans un ordre particulier :
- Keeogo Système Dermoskeleton de B-Temia, exosquelette de genou motorisé
- HAL à usage médical (type membres inférieurs) de CYBERDYNE, exosquelette de hanche et de genou motorisé
- EksoNR exosquelette hanche-genou propulsé par Ekso Bionics
- ExoAtlet-II d'ExoAtlet Asia, également un exosquelette de hanche et de genou motorisé
- Honda Walking Assist Device, Honda Motor Company, exosquelette de hanche motorisé
- IndegoExosquelette de la hanche et du genou, officiellement fabriqué par Parker-Hannifin Corporation, récemment racheté par EksoBionics.
- ReWalk de ReWalk Robotics, exosquelette de hanche et de genou motorisé
- ReWalk ReStore de ReWalk Robotics, exosuit motorisé à la cheville
- GEMS-H de Samsung Electronics, exosquelette de hanche motorisé
- Phoenix d'Ottobock, officiellement suitX (qui était lui-même officiellement US Bionics), est un exosquelette de hanche motorisé avec soutien passif du genou.
- Atalante exosquelette hanche-genou-cheville propulsé par Wandercraft SAS
À partir de mars 2023, seul l'exosquelette ReWalk sera approuvé par la FDA pour une utilisation avec des escaliers et des bordures. Seuls ReWalk Personal et Indego sont approuvés pour un usage privé ou domestique. Tous les appareils peuvent être utilisés dans l'environnement d'un centre de rééducation. L'Atalante est le seul exosquelette auto-équilibré approuvé par la FDA (bien que le REX pourrait bientôt être ajouté à la liste). Les autres appareils ont soit des aides à la mobilité supplémentaires optionnelles ou nécessaires, comme des béquilles ou un déambulateur. Il existe plusieurs dispositifs, comme l'Atalante, qui peuvent éventuellement être utilisés par des adolescents (mais il n'y a pas d'exosquelettes pédiatriques sur cette liste). Tous les opérateurs doivent suivre un programme de formation avant d'utiliser les exosquelettes.
Certains exosquelettes propulsés approuvés par la FDA ont des considérations spéciales de protection contre les chutes et d'atténuation, en particulier :
- Atalante : doit être utilisé en combinaison avec un garde-corps de sécurité.
- ReWalk doit être utilisé avec des béquilles. L'Indego, l'ExoAtlet-II (et probablement le Phoenix) doivent être utilisés avec des béquilles ou un déambulateur, tandis que l'EksoNR peut être utilisé avec des béquilles, un déambulateur ou une canne.
- L'appareil d'assistance respiratoire à usage médical doit être fixé à un système de support du poids du corps (généralement au-dessus de la tête).
- Toutes les versions du ReWalk et de l'Indego, à l'exception des versions destinées à un usage domestique, ont été approuvées pour être utilisées uniquement sous la supervision d'un professionnel de santé qualifié.
Le cas Ese envisagé pour les exosquelettes motorisés approuvés par la FDA vise à aider les patients/utilisateurs à marcher avec :
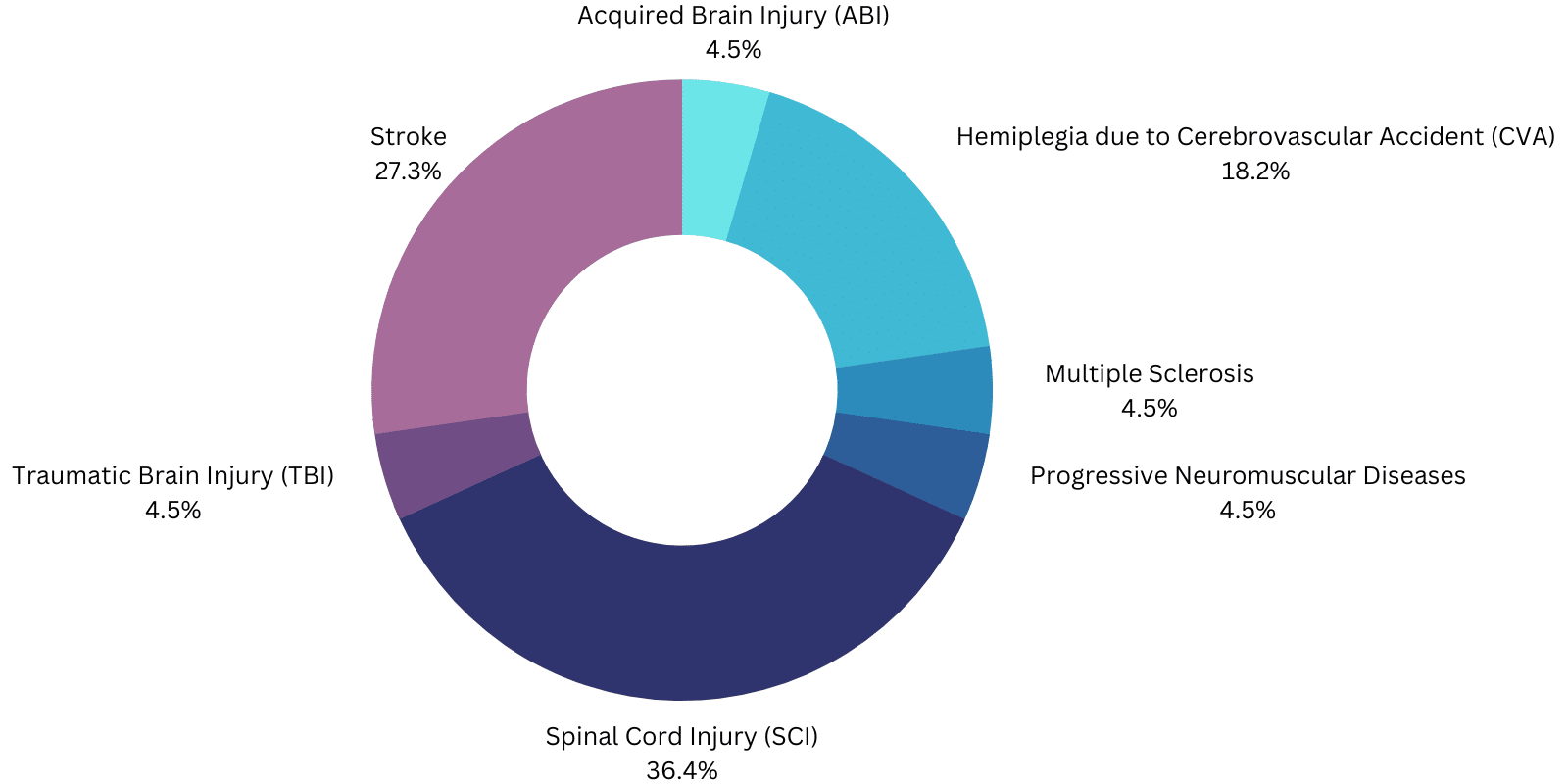
- ExoAtlet-II est destiné à la rééducation fonctionnelle, sous la supervision d'un kinésithérapeute qualifié, de personnes ayant une fonction motrice des membres supérieurs d'au moins 4/5 dans les deux bras, et présentant des lésions de la moelle épinière (SCI) T4 à L5 ou C7 à T3 (ASIA D ).
- Phoenix : Lésion de la moelle épinière (SCI) de niveau T4-L5.
- Atalante : hémiplégie due à un accident cérébrovasculaire (CVA).
- GEMS-H : personnes ayant subi un AVC, présentant des déficits de la marche et ayant des vitesses de marche d'au moins 0,4 m/s et capables de marcher au moins 10 mètres avec l'aide d'une personne au maximum.
- ReWalk : SCI T7 à L5 pour un usage personnel sous surveillance permanente ou SCI T4 à T6 pour la rééducation physique dans un établissement spécialisé.
- ReWalk Restore : doit être "utilisé pour soutenir les fonctions ambulatoires dans les établissements de réadaptation, sous la supervision d'un thérapeute formé, pour les personnes atteintes d'hémiplégie/hémiparésie due à un accident vasculaire cérébral qui peuvent marcher au moins 1,5 m (5 pieds) avec une assistance qui n'est pas supérieure à un niveau minimal ou modéré" .
- Indego : aide ambulatoire pour les SCI de niveau T3 à L5 à usage personnel avec surveillance et SCI de niveau C7 à L5 dans les centres de rééducation ou hémiplégie due à une AVC avec fonction motrice 4/5 dans au moins un membre supérieur.
- Honda Walking Assist : "personnes ayant subi un AVC, présentant des déficits de la marche et ayant des vitesses de marche d'au moins 0,4 m/s et capables de marcher au moins 10 mètres avec l'aide d'une personne au maximum" dans les centres de rééducation.
- EksoNR : "L'EksoNRm doit exercer des fonctions ambulatoires dans des établissements de rééducation, sous la supervision d'un kinésithérapeute formé, pour les populations suivantes :
- Personnes atteintes de sclérose en plaques (fonction motrice du membre supérieur d'au moins 4/5 dans au moins un bras).
- Personnes ayant subi une lésion cérébrale acquise, y compris une lésion cérébrale traumatique et un accident vasculaire cérébral (fonction motrice du membre supérieur d'au moins 4/5 dans au moins un bras).
- Personnes souffrant de lésions de la moelle épinière de niveau T4 à L5 (fonction motrice du membre supérieur d'au moins 4/5 dans les deux bras).
- Personnes présentant des lésions de la moelle épinière aux niveaux C7 à T3 (ASIA D avec une fonction motrice des membres supérieurs d'au moins 4/5 dans les deux bras).
Limites de taille et de poids déclarées pour les utilisateurs :
| appareil : | Plage de hauteur de l'utilisateur | Plage de poids de l'utilisateur |
| GEMS-H | 1,55m à 1,91m | 45 à 100 kg |
| Atalanta | 1,60 à 1,90 cm | jusqu'à 90 kg |
| Phénix | 1,60m à 1,87m | jusqu'à 91 kg |
| ReWalk | 1,60m à 1,90m | jusqu'à 100 kg |
| Récupération ReWalk | 1,42m à 1,92m | jusqu'à 120 kg |
| J'ai besoin | 1,50m à 1,90m | jusqu'à 113 kg |
| Déambulateur Honda | 1,4m à 2,0m | jusqu'à 100 kg |
| ExoAthlete-II | 1,60m à 1,90m | jusqu'à 100 kg |
| ExoNR | 1,58m à 1,88m | jusqu'à 100 kg |
| HAL à des fins médicales | 1,50m à 1,90m | 40 à 100 kilos |
| Le système dermosquelettique de Keego | 1,52m à 1,88m | jusqu'à 130 kg |
Si vous voyez des erreurs ou souhaitez un article sur un sujet particulier, n'hésitez pas à nous contacter via le formulaire de contact ExR . Image sélectionnée (ci-dessus) : Démonstration de l'Ekso GT par Shane Mosko et la kinésithérapeute Jenn Macievich au siège d'Ekso Bionics, Richmond, 2016 (arrière-plan retiré).
Source :
- Classification des produits, FDA, accès mars 2023, Lien
- Palermo AE, Maher JL, Baunsgaard CB, Nash MS. Aperçu clinique de l'utilisation d'un exosquelette bionique après une lésion de la moelle épinière. Top Spinal Cord Inj Rehabilitation. Été 2017;23(3):234-244. doi : 10.1310/sci2303-234. PMID : 29339899 ; PMC-ID : PMC5562031.
- Évaluation de la sécurité et de la performance du système Atalante chez les patients souffrant d'un membre inférieur
- Paralysis, NIH, 2018, Lien
Source d'origine : Utilisation prévue des 11 exosquelettes médicaux approuvés par la FDA dans le Medical Exoskeleton Report 2023
