A marzo 2023, 11 esoscheletri medici sono stati approvati dalla FDA statunitense per la deambulazione, il supporto del cammino e la riabilitazione fisica. L'FDA classifica gli esoscheletri motorizzati per uso medico come dispositivi di Classe II, codice PHL, con la definizione esatta che segue: "Un esoscheletro motorizzato è un dispositivo da prescrizione che consiste in un'ortesi esterna, motorizzata e alimentata, che viene posizionata sull'estremità inferiore paralizzata o debilitata di una persona per scopi medici".
Gli 11 esoscheletri medici sono in ordine sparso:
- Keeogo Sistema Dermoscheletro di B-Temia, esoscheletro alimentato al ginocchio
- HAL per scopi medici (tipo arto inferiore) di CYBERDYNE, esoscheletro motorizzato anca-ginocchio
- EksoNR Esoscheletro anca-ginocchio alimentato da Ekso Bionics
- ExoAtlet-II da ExoAtlet Asia, anche un esoscheletro alimentato per l'anca e il ginocchio.
- Dispositivo di assistenza alla deambulazione Honda, Honda Motor Company, esoscheletro dell'anca alimentato
- Indegoufficialmente da Parker-Hannifin Corporation, recentemente acquisita da EksoBionics, esoscheletro alimentato per l'anca e il ginocchio
- ReWalk da ReWalk Robotics, esoscheletro motorizzato anca-ginocchio
- ReWalk ReStore da ReWalk Robotics, esosuit motorizzata per la caviglia
- GEMS-H di Samsung Electronics, esoscheletro alimentato per l'anca
- Phoenix di Ottobock, ufficialmente suitX (che a sua volta era ufficialmente US Bionics), è un esoscheletro alimentato per l'anca con supporto passivo per il ginocchio.
- Atalanta Esoscheletro anca-ginocchio-caviglia alimentato da Wandercraft SAS
A partire da marzo 2023, solo l'esoscheletro ReWalk è approvato dalla FDA per l'uso con scale e marciapiedi. Solo ReWalk Personal e Indego sono approvati per uso privato o domestico. Tutti i dispositivi possono essere utilizzati in un centro di riabilitazione. Atalante è l'unico esoscheletro autobilanciato approvato dalla FDA (anche se il REX potrebbe presto essere aggiunto all'elenco). Gli altri dispositivi sono dotati di ausili di mobilità aggiuntivi opzionali o necessari, come stampelle o deambulatori. Ci sono diversi dispositivi, come l'Atalante, che possono potenzialmente essere utilizzati dagli adolescenti (ma non ci sono esoscheletri pediatrici in questo elenco). Tutti gli operatori devono completare un programma di formazione prima di utilizzare gli esoscheletri.
Alcuni degli esoscheletri motorizzati approvati dalla FDA hanno considerazioni speciali sulla protezione e la riduzione delle cadute, in particolare:
- Atalante: deve essere utilizzato in combinazione con una ringhiera di sicurezza.
- ReWalk deve essere utilizzato con le stampelle. L'Indego, l'ExoAtlet-II (e probabilmente il Phoenix) devono essere utilizzati con stampelle o un rollator, mentre l'EksoNR può essere utilizzato con stampelle, un rollator o un bastone da passeggio.
- L'HAL per uso medico deve essere attaccato a un sistema di supporto del peso corporeo (normalmente sopra la testa).
- Tutte le versioni di ReWalk e Indego, ad eccezione delle versioni per uso domestico, sono state approvate per l'uso solo sotto la supervisione di un professionista sanitario qualificato.
La custodia Ese prevista per gli esoscheletri motorizzati approvati dalla FDA è progettata per aiutare i pazienti/utenti a camminare:
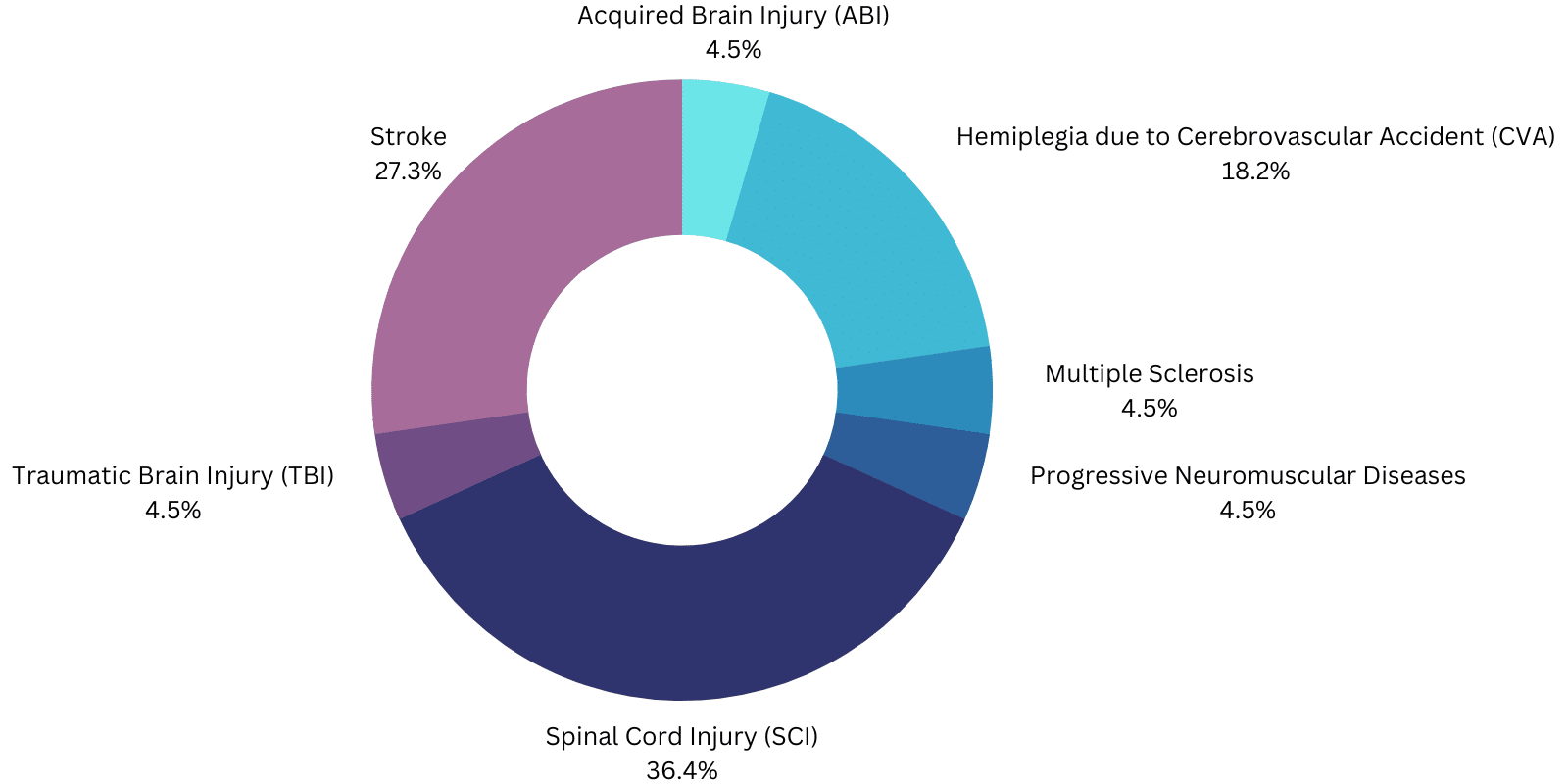
- ExoAtlet-II è destinato alla riabilitazione funzionale di persone con funzione motoria degli arti superiori di almeno 4/5 in entrambe le braccia, con lesioni del midollo spinale (SCI) da T4 a L5 o da C7 a T3 (ASIA D ), sotto la supervisione di un fisioterapista esperto.
- Phoenix: Lesione del midollo spinale (SCI) a livello T4-L5.
- Atalante: Emiplegia dovuta a un incidente cerebrovascolare (CVA).
- GEMS-H: persone con ictus che presentano deficit di deambulazione e velocità di deambulazione di almeno 0,4 m/s e sono in grado di camminare per almeno 10 metri con l'aiuto di una persona al massimo.
- ReWalk: SCI T7 a L5 per uso personale sotto costante supervisione o SCI T4 a T6 per riabilitazione fisica in una struttura specializzata.
- ReWalk Restore: deve essere "utilizzato per supportare la funzione deambulatoria nelle strutture di riabilitazione, sotto la supervisione di un terapista esperto, per le persone con emiplegia/emiparesi dovuta a ictus che possono camminare per almeno 1,5 metri (5 piedi) con un supporto minimo o moderato".
- Indego: assistenza ambulatoriale per livelli di SCI da T3 a L5 per uso personale con monitoraggio e livelli di SCI da C7 a L5 in centri di riabilitazione o emiplegia dovuta a CVA con funzione motoria 4/5 in almeno un arto superiore.
- Honda Walking Assist: "Persone con ictus che presentano deficit di deambulazione e velocità di deambulazione di almeno 0,4 m/s e sono in grado di camminare per almeno 10 metri con l'aiuto di una persona al massimo" nelle strutture di riabilitazione.
- EksoNR: "L'EksoNRm è destinato a svolgere funzioni ambulatoriali in strutture di riabilitazione sotto la supervisione di un fisioterapista esperto per le seguenti popolazioni:
- Persone con sclerosi multipla (funzione motoria dell'arto superiore di almeno 4/5 in almeno un braccio).
- Persone con lesioni cerebrali acquisite, tra cui lesioni cerebrali traumatiche e ictus (funzione motoria dell'arto superiore di almeno 4/5 in almeno un braccio).
- Persone con lesioni del midollo spinale ai livelli da T4 a L5 (funzione motoria dell'arto superiore di almeno 4/5 in entrambe le braccia).
- Persone con lesioni del midollo spinale ai livelli da C7 a T3 (ASIA D con funzione motoria degli arti superiori di almeno 4/5 in entrambe le braccia).
Restrizioni di altezza e di peso segnalate per gli utenti:
| Dispositivo: | Altezza dell'utente | Fascia di peso dell'utente |
| GEMS-H | Da 1,55 m a 1,91 m | Da 45 a 100 kg |
| Atalanta | Da 1,60 a 1,90 cm | fino a 90 kg |
| Phoenix | Da 1,60 m a 1,87 m | fino a 91 kg |
| ReWalk | Da 1,60 m a 1,90 m | fino a 100 kg |
| Recupero ReWalk | Da 1,42 m a 1,92 m | fino a 120 kg |
| Ho bisogno di | Da 1,50 m a 1,90 m | fino a 113 kg |
| Ausilio per la deambulazione Honda | Da 1,4 m a 2,0 m | fino a 100 kg |
| ExoAtleta-II | Da 1,60 m a 1,90 m | fino a 100 kg |
| ExoNR | Da 1,58 m a 1,88 m | fino a 100 kg |
| HAL per scopi medici | Da 1,50 m a 1,90 m | Da 40 a 100 chili |
| Sistema dermoscheletrico di Keego | Da 1,52 m a 1,88 m | fino a 130 kg |
Se nota degli errori o desidera un articolo su un argomento specifico, non esiti a contattarci utilizzando il modulo di contatto ExR. Immagine in primo piano (sopra): Dimostrazione di Ekso GT da parte di Shane Mosko e della fisioterapista Jenn Macievich presso la sede centrale di Ekso Bionics, Richmond, 2016 (sfondo rimosso).
Fonte:
- Classificazione dei prodotti, FDA, accesso a marzo 2023, Link
- Palermo AE, Maher JL, Baunsgaard CB, Nash MS. Revisione orientata al clinico dell'uso di un esoscheletro bionico dopo una lesione al midollo spinale. Top Spinal Cord Inj Rehabil. Estate 2017;23(3):234-244. doi: 10.1310/sci2303-234. PMID: 29339899; PMC ID: PMC5562031.
- Valutazione della sicurezza e delle prestazioni del sistema Atalante nei pazienti con arto inferiore.
- Paralisi, NIH, 2018, Link
Fonte di origine: Uso previsto degli 11 esoscheletri medici approvati dalla FDA nel Rapporto sugli esoscheletri medici 2023.
