Hasta marzo de 2023, la FDA estadounidense había aprobado 11 exoesqueletos médicos para la marcha, la asistencia a la marcha y la rehabilitación física. La FDA clasifica los exoesqueletos médicos motorizados como dispositivos de clase II, código PHL, cuya definición exacta es la siguiente: "Un exoesqueleto motorizado es un dispositivo de prescripción que consiste en una órtesis externa motorizada que se coloca sobre la(s) extremidad(es) abdominal(es) paralizada(s) o debilitada(s) de una persona con fines médicos".
Los 11 exoesqueletos médicos no están en ningún orden en particular:
- Keeogo Dermoskeleton System de B-Temia, exoesqueleto de rodilla motorizado
- HAL para uso médico (tipo miembro inferior) de CYBERDYNE, exoesqueleto motorizado de cadera y rodilla
- EksoNR Exoesqueleto motorizado de cadera y rodilla de Ekso Bionics
- ExoAtlet-II de ExoAtlet Asia, también un exoesqueleto motorizado de cadera y rodilla
- Honda Walking Assist Device, Honda Motor Company, Exoesqueleto eléctrico de cadera
- Indego, oficialmente de Parker-Hannifin Corporation, recientemente adquirida por EksoBionics, exoesqueleto motorizado de cadera y rodilla.
- ReWalk de ReWalk Robotics, exoesqueleto motorizado de cadera y rodilla
- ReWalk ReStore de ReWalk Robotics, exosuit motorizado para el tobillo
- GEMS-H de Samsung Electronics, exoesqueleto de cadera motorizado
- Phoenix de Ottobock, oficialmente suitX (que a su vez era oficialmente US Bionics), es un exoesqueleto motorizado de cadera con soporte pasivo de rodilla
- Atalante Exoesqueleto motorizado de cadera-rodilla-tobillo Wandercraft SAS
A partir de marzo de 2023, solo el exoesqueleto ReWalk está aprobado por la FDA para su uso en escaleras y bordillos. Sólo ReWalk Personal e Indego están aprobados para uso privado o doméstico. Todos los dispositivos pueden utilizarse en un entorno de centro de rehabilitación. El Atalante es el único exoesqueleto de autoequilibrio aprobado por la FDA (aunque es posible que el REX se añada pronto a la lista). El resto de los dispositivos tienen ayudas de movilidad adicionales opcionales o necesarias, como muletas o un andador. Hay varios dispositivos, como el Atalante, que pueden ser utilizados por adolescentes (pero no hay exoesqueletos pediátricos en esta lista). Todos los operadores deben completar un programa de formación antes de utilizar los exoesqueletos.
Algunos de los exoesqueletos eléctricos aprobados por la FDA tienen consideraciones especiales de protección y mitigación de caídas, en concreto:
- Atalante: debe utilizarse en combinación con una barandilla de seguridad.
- El ReWalk debe utilizarse con muletas. El Indego, el ExoAtlet-II (y probablemente el Phoenix) deben utilizarse con muletas o un rollator, mientras que el EksoNR puede utilizarse con muletas, un rollator o un bastón.
- El HAL para fines médicos debe sujetarse a un sistema de soporte de peso corporal (normalmente por encima de la cabeza).
- Todas las versiones del ReWalk e Indego, a excepción de las de uso doméstico, han sido aprobadas para su uso únicamente bajo la supervisión de un profesional médico cualificado.
El caso Ese previsto para los exoesqueletos eléctricos aprobados por la FDA es ayudar a los pacientes/usuarios a caminar con:
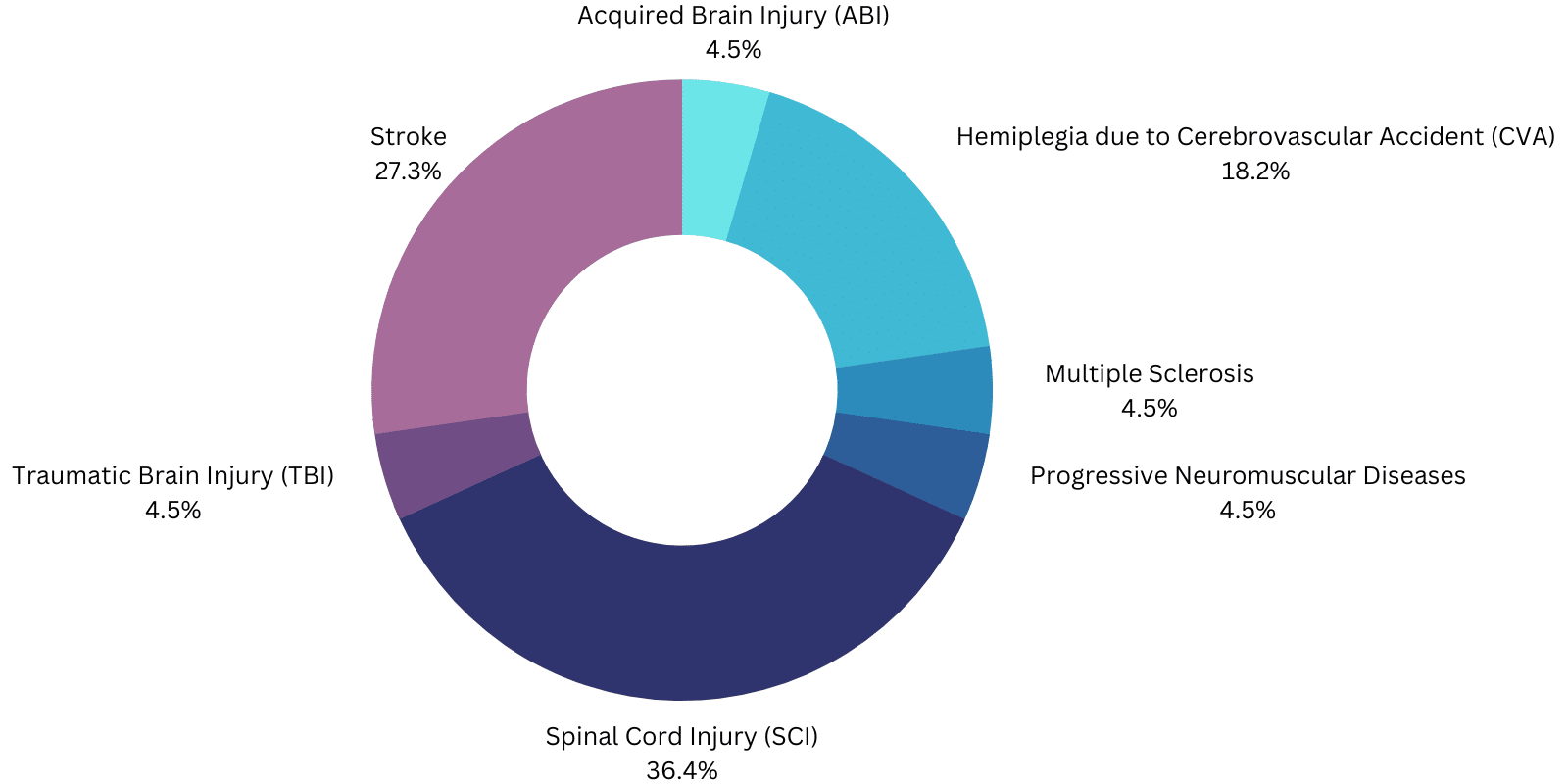
- ExoAtlet-II está destinado a la rehabilitación funcional de personas bajo la supervisión de un fisioterapeuta cualificado con una función motora de las extremidades superiores de al menos 4/5 en ambos brazos, lesión medular (LME) T4 a L5 o C7 a T3 (ASIA D ).
- Phoenix: Lesión medular (LME) del nivel T4-L5.
- Atalante: Hemiplejia por accidente cerebrovascular (ACV).
- GEMS-H: Personas con apoplejía que presentan déficits en la marcha y velocidades de marcha de al menos 0,4 m/s y son capaces de caminar al menos 10 metros con la ayuda de una sola persona.
- ReWalk: SCI T7 a L5 para uso personal bajo supervisión constante o SCI T4 a T6 para rehabilitación física en un centro especial.
- ReWalk Restore: debe "utilizarse para apoyar las funciones ambulatorias en centros de rehabilitación bajo la supervisión de un terapeuta formado para personas con hemiplejia/hemiparesia debida a un ictus que puedan caminar al menos 1,5 m sin más apoyo que el mínimo o moderado ."
- Indego: Asistencia ambulatoria para los niveles de LME T3 a L5 para uso personal con seguimiento y los niveles de LME C7 a L5 en centros de rehabilitación o hemiplejia por AVC con función motora 4/5 en al menos una extremidad superior.
- Honda Walking Assist: "Personas con apoplejía que presentan déficits en la marcha y velocidades de al menos 0,4 m/s y son capaces de caminar al menos 10 metros con la ayuda de una sola persona" en centros de rehabilitación.
- EksoNR: "El EksoNRm es para realizar funciones ambulatorias en centros de rehabilitación bajo la supervisión de un fisioterapeuta formado para las siguientes poblaciones:
- Personas con esclerosis múltiple (función motora de las extremidades superiores de al menos 4/5 en al menos un brazo).
- Individuos con lesión cerebral adquirida, incluyendo lesión cerebral traumática y apoplejía (función motora de las extremidades superiores de al menos 4/5 en al menos un brazo).
- Personas con lesiones medulares de los niveles T4 a L5 (función motora del miembro superior de al menos 4/5 en ambos brazos).
- Individuos con lesiones medulares en los niveles C7 a T3 (ASIA D con función motora de las extremidades superiores de al menos 4/5 en ambos brazos).
Informó de las restricciones de altura y peso para los usuarios:
| Dispositivo: | Rango de altura del usuario | Rango de peso del usuario |
| GEMS-H | De 1,55 m a 1,91 m | De 45 a 100 kg |
| Atalanta | 1,60 a 1,90 cm | hasta 90 kg |
| Phoenix | De 1,60 m a 1,87 m | hasta 91 kg |
| ReWalk | De 1,60 m a 1,90 m | hasta 100 kg |
| Recuperación ReWalk | De 1,42 m a 1,92 m | hasta 120 kg |
| Necesito | De 1,50 m a 1,90 m | hasta 113 kg |
| Andador Honda | De 1,4 m a 2,0 m | hasta 100 kg |
| ExoAthlete-II | De 1,60 m a 1,90 m | hasta 100 kg |
| ExoNR | De 1,58 m a 1,88 m | hasta 100 kg |
| HAL con fines médicos | De 1,50 m a 1,90 m | De 40 a 100 kilos |
| El sistema dermoesquelético de Keego | De 1,52 m a 1,88 m | hasta 130 kg |
Si observa algún error o desea un artículo sobre un tema concreto, no dude en ponerse en contacto con nosotros a través del formulario de contacto de ExR . Imagen destacada (arriba): Demostración del Ekso GT por Shane Mosko y la fisioterapeuta Jenn Macievich en la sede de Ekso Bionics, Richmond, 2016 (fondo eliminado).
Fuente:
- Clasificación de productos, FDA, consultado en marzo de 2023, Enlace
- Palermo AE, Maher JL, Baunsgaard CB, Nash MS. Revisión orientada al clínico del uso de un exoesqueleto biónico tras una lesión medular. Top Spinal Cord Inj Rehabil. Verano de 2017;23(3):234-244. doi: 10.1310/sci2303-234. PMID: 29339899; PMC ID: PMC5562031.
- Evaluación de la seguridad y el rendimiento del sistema Atalante en pacientes con extremidades inferiores
- Parálisis, NIH, 2018, Enlace
Fuente: Propuesta de uso de los 11 exoesqueletos médicos aprobados por la FDA en el Informe sobre exoesqueletos médicos 2023.
